Химийн индикатор: Засвар хоорондын ялгаа
No edit summary |
No edit summary |
||
| Мөр 7: | Мөр 7: | ||
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки. |
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки. |
||
<!-- фенолфталеин, который раньше использовали также в качестве слабительного средства под названием пурген. В кислой среде это соединение находится в виде недиссоциированных молекул, и раствор бесцветен, а в щелочной – в виде однозарядных анионов, и раствор имеет малиновый цвет. Однако в сильнощелочной среде фенолфталеин снова обесцвечивается! Происходит это из-за образования еще одной бесцветной формы индикатора – в виде трехзарядного аниона. Наконец, в среде концентрированной серной кислоты снова появляется красная окраска, хотя и не такая интенсивная. Ее виновник – катион фенолфталеина. Этот малоизвестный факт может привести к ошибке при определении реакции среды. |
|||
лакмус. Еще в 1640 ботаники описали гелиотроп (Heliotropium Turnesole) – душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной – синим. Об этом можно прочитать в трудах знаменитого физика и химика XVII века Роберта Бойля. Вначале с помощью нового индикатора исследовали минеральные воды, а примерно с 1670 года его начали использовать в химических опытах. «Как только вношу незначительно малое количество кислоты, – писал в 1694 французский химик Пьер Поме о „турнесоле", – он становится красным, поэтому если кто хочет узнать, содержится ли в чем-нибудь кислота, его можно использовать». В 1704 немецкий ученый М.Валентин назвал эту краску лакмусом; это слово и осталось во всех европейских языках, кроме французского; по-французски лакмус – tournesol, что дословно означает «поворачивающийся за солнцем». Так же французы называют и подсолнечник; кстати, «гелиотроп» означает то же самое, только по-гречески. Вскоре оказалось, что лакмус можно добывать и из более дешевого сырья, например, из некоторых видов лишайников. |
|||
К сожалению, почти у всех природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся – скисают или плесневеют (более устойчивы спиртовые растворы). Другой недостаток – слишком широкий интервал изменения цвета. При этом трудно или невозможно отличить, например, нейтральную среду от слабокислой или слабощелочную от сильнощелочной. Поэтому в химических лабораториях используют синтетические индикаторы, резко изменяющие свой цвет в достаточно узких границах рН. Таких индикаторов известно множество, и каждый из них имеет свою область применения. Например, метиловый фиолетовый изменяет окраску от желтой до зеленой в интервале рН 0,13 – 0,5; метиловый оранжевый – от красной (рН < 3,1) до оранжево-желтой (рН 4); бромтимоловый синий – от желтой (рН < 6,0) до сине-фиолетовой (рН 7,0); фенолфталеин – от бесцветной (рН < 8,2) до малиновой (рН 10); тринитробензол – от бесцветной (pH < 12,2) до оранжевой (рН 14,0). |
|||
Широкое распространение получили комплесонометрические индикаторы – вещества, образующие с ионами металлов (многие из которых бесцветны) окрашенные комплексные соединения. Примером может служить эриохром черный Т; раствор этого сложного органического соединения имеет синий цвет, а в присутствии ионов магния, кальция и некоторых других образуются комплексы, окрашенные в интенсивный винно-красный цвет. Анализ ведут так: к раствору, содержащему анализируемые катионы и индикатор, добавляют по каплям более сильный, по сравнению с индикатором, комплексообразователь, чаще всего – трилон Б. Как только трилон полностью свяжет все катионы металлов, произойдет отчетливый переход от красного цвета к синему. По количеству добавленного трилона легко вычислить содержание катионов металла в растворе. |
|||
Известны и другие виды индикаторов. Например, некоторые вещества адсорбируются на поверхности осадка, изменяя его окраску; такие индикаторы называются адсорбционными. При титровании мутных или окрашенных растворов, в которых практически невозможно заметить изменение окраски обычных кислотно-основных индикаторов, используют флуоресцентные индикаторы. Они светятся (флуоресцируют) разным цветом в зависимости от рН раствора. Например, флуоресценция акридина изменяется от зеленой при рН = 4,5 до синей при рН = 5,5; при этом важно, что свечение индикатора не зависит от прозрачности и собственной окраски раствора. |
|||
== Индикаторуудын молекулын бүтэц ба өнгө == |
== Индикаторуудын молекулын бүтэц ба өнгө == |
||
06:15, 26 Хоёрдугаар сар 2013-ий байдлаарх засвар
Индика́тор (лат. indicator – заагч) — бодисын эсвэл түүний аль нэг бурдүүлэгчийн агууламжийн (концентраци) өөрчлөлтийг нүдэнд харагдахуйцаар (нүдээр тодорхойлж болохоор) илэрхийлэх нэгдэл (бодис). Жишээ нь, титрлэлтийн үед эсвэл рН, еН г.м. үзүүлэлтүүдийг богино хугацаанд тодорхойлоход ашиглагддаг. Янз бүрийн тусгай зориулалтын индикаторууд байдаг. Жишээ нь цацраг идэвхжилийн хэмжээг тодорхойлох.
Индикаторуудын хэрэглээ
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета - изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Индикаторуудын молекулын бүтэц ба өнгө
Трифенилметаны будаг - индикаторууд
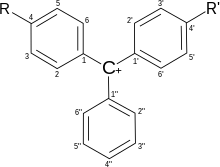
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
| Название \ Положение | 2" | 2 | 3 | 4 | 5 | 2' | 3' | 4' | 5' |
|---|---|---|---|---|---|---|---|---|---|
| Бромтимоловый синий | SO3− | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Бромфеноловый синий | SO3− | H | Br | OH | Br | H | Br | OH | Br |
| Бромкрезоловый зелёный | SO3− | Me | Br | OH | Br | Me | Br | OH | Br |
| Крезоловый красный | SO3− | H | Me | OH | H | H | Me | OH | H |
| Фенолфталеин | CO2− | H | H | OH | H | H | H | OH | H |
| Тимолфталеин | CO2− | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Малахитовый зелёный | H | H | H | NMe2 | H | H | H | NMe2 | H |
Производные азобензола

.
Виды индикаторов
- Кислотно-основные индикаторы
- Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет
- Металлоиндикаторы
- Адсорбционные индикаторы
Распространённые кислотно-основные индикаторы
| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | Интервалы pH |
|---|---|---|---|
| Ализариновый желтый | желтый | фиолетовый | 10,1 - 12,1 |
| Тимолфталеин | бесцветный | синий | 9,4 - 10,6 |
| Фенолфталеин | бесцветный | красный | 8,2 - 10,0 |
| Крезоловый красный | желтый | тёмно-красный | 7,0 - 8,8 |
| Нейтральный красный | красный | коричневый | 6,8 - 8,0 |
| Феноловый красный | желтый | красный | 6,8 - 8,0 |
| Бромтимоловый синий | желтый | синий | 6,0 - 7,6 |
| Лакмус (азолитмин) | красный | синий | 5,0 - 8,0 |
| Метиловый красный | красный | желтый | 4,4 - 6,2 |
| Метиловый оранжевый | розовый, желтый | желтый | 3,0 - 4,4 |
| Бромфеноловый синий | красный | синий | 3,0 - 4,6 |
| Тропеолин 00... | - | желтый | 1,4 - 3,2 |
