Фенилаланин
 L-Фенилаланин
| |
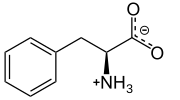 L-Фенилаланин физиологийн рН
| |
 3D фенилаланины загвар
| |
| Нэр | |
|---|---|
| IUPAC нэр
(S)-2-Амин хүчил-3-фенилпропанийн хүчил
| |
| Шинж чанар | |
| C9H11NO2 | |
| Моль масс | 165.19 g·mol−1 |
| Хүчиллэг (pKa) | 1.83 (carboxyl), 9.13 (amino)[1] |
Өөрөөр тодотгож заагаагүй бол бодисуудын хэвийн төлөв (25 °C [77 °F], 100 kPa) дахь үзүүлэлтүүд. | |
| | |
| Мэдээлэлийн хайрцагны эх сурвалж | |
Фенилаланин (тэмдэг нь Phe эсвэл F) нь C9H11NO2 томъёотой α-амин хүчил юм.Үүнийг аланины метилийн бүлгээр сольж байсан бензилийн бүлэг буюу аланины эцсийн устөрөгчийн оронд фенил бүлэгтэй гэж үзэж болно. Энэхүү амин хүчил гинжин хэлхээний инерц ба гидрофобик шинэ чанараас болж төвийг сахисан гэж ангилдаг. L-изомерыг биохимийн аргаар ДНХ-ээр кодлогдсон уураг үүсгэхэд ашигладаг. Фенилаланин нь тирозин, моноамин,допамин, норэпинефрин,эпинефрин,адреналин,пигмент меланин зэрэг хүчин зүйл юм. Энэ нь UUU болон UUC кодлогч кодчилдог.
Түүх
[засварлах | кодоор засварлах]Фенилаланины анхны тодорхойлолтыг 1879 онд Шулзе, Барбиери нар шар өнгийн лупины суулгацад C9H11NO2 эмпирик томъёогоор нэгтгэсэн болохыг тогтоосон.1882 онд Эрленмейер, Липп нар фенилацетальдегид, устөрөгчийн цианид, аммиакаас фенилаланиныг анх удаа синтезжүүлсэн.Фенилаланины генетикийн катоныг анх 1961 онд Ж.Хейнрих Маттай, Маршалл В.Ниренберг нар нээсэн.Тэд mRNA-г ашиглан олон тооны uracil-ийн давталтыг бактерийн E. coli-ийн геномд оруулснаар бактери нь зөвхөн давтан фенилаланины амин хүчлүүдээс бүрдэх полипептид үүсгэдэг болохыг харуулж байна.Энэхүү нээлт нь геномын нуклейн хүчилд хадгалагдаж буй мэдээллийг амьд эсийн уургийн илэрхийлэлтэй холбосон кодлох харилцааны мөн чанарыг тогтооход тусалсан юм.
Гарал үүсэл
[засварлах | кодоор засварлах]Фенилаланин нь хөхтөн,хөхний сүүнд байгалийн гаралтай байдаг. Энэ нь хоол хүнс, ундаа үйлдвэрлэхэд ашиглагддаг бөгөөд өвдөлт намдаах, антидепрессант нөлөөтэй хоол тэжээлийн нэмэлт болгон борлуулдаг. Энэ нь түгээмэл хэрэглэгддэг хоолны нэмэлт тэжээл болох нейромодулятор фенетиламиныг шууд үүсгэдэг. Чухал амин хүчил болох фенилаланин нь хүн болон бусад амьтдад фенилаланин агуулсан уураг шингээж авахгүй.
Хоолны гарал үүсэл
[засварлах | кодоор засварлах]Фенилаланины сайн эх үүсвэр нь өндөг, тахиа, элэг, үхрийн мах, сүү, шар буурцаг юм.Фенилаланины өөр нэг түгээмэл эх үүсвэр бол хоолны дэглэм, ундаа, эм гэх мэт чихэрлэг аспарагтай зүйл юм. Аспартамын метаболизм нь нэгдлүүдийн метаболитуудын нэг болох фенилаланиныг үүсгэдэг. АНУ-ын Анагаах Ухааны Институтийн Хүнс, тэжээлийн зөвлөл (FNB) нь 2002 онд шаардлагатай амин хүчлүүдийн санал болгосон хоолны дэглэмийг тогтоосон.Фенилаланин ба тирозиныг хэрэглэхэд 19 ба түүнээс дээш насны хүмүүст өдөрт 33 мг / кг биеийн жин орно.
Шинж чанарууд
[засварлах | кодоор засварлах]Фенилаланин бол хайлах үед задардаг өнгөгүй талст бодис юм.Вакуумд халаахад сублиматууд орно.Энэ нь усанд бага зэрэг уусдаг, этилийн спиртээр уусдаг.Азотын хүчилтэй бол ксантопротеины урвал өгдөг.Халаахад декарбоксилждэг.
Биологийн функц
[засварлах | кодоор засварлах]Биосинтез
[засварлах | кодоор засварлах]Фенилаланины биосинтезийн явцад завсрын нэгдлүүд нь шикима, хоризмат, префенат юм. Байгалийн фенилаланиныг бичил биет, мөөгөнцөр, ургамал синтезжүүлдэг.Бүх метазоагийн хувьд хүний хувьд фенилаланин нь зайлшгүй шаардлагатай амин хүчил бөгөөд хүнсний уургаар хангалттай хэмжээгээр шингэх ёстой.
Катаболизм
[засварлах | кодоор засварлах]Байгалийн хувьд фенилаланины биодезийн хэд хэдэн замыг мэддэг.Фенилаланин ба тирозиныг катаболизмын янз бүрийн организмд метаболизмын үндсэн завсрын бүтээгдэхүүн бол фумарат, пируват, сукцинат, ацетоцетат, ацетальдегид юм. Амьтад, хүмүүст фенилаланин ба тирозин нь фумарат (глюконеогенезийн субстрат болох оксалаоцетат болж хувирдаг) ба ацетоцетат (цусан дахь кетон биений түвшинг нэмэгдүүлдэг) тул эдгээр амин хүчлийг амьтдын катаболизмын шинж чанараар глюкоз-кетоген (холимог) гэж ангилдаг.Амьтан, хүний биед фенилаланины метаболизын үндсэн хувиргалт бол амин хүчил болох тирозин үүсгэдэг фермент гидроксилизаци юм.

Фенилаланиныг тирозин болгон хувиргах нь илүүдэл фенилаланиныг зайлуулахаас гадна тирозины сэргээхэд илүү их шаардлагатай байдаг, учир нь тирозин нь ихэвчлэн хүнсний уургаар хангалттай хэмжээгээр ирдэг бөгөөд түүний дутагдал нь ихэвчлэн тохиолддоггүй. Энэ нь цаашдын катаболик хувиргалтыг явуулдаг тирозин юм. Фенилаланин нь фенилпропаноидын үндсэн бэлдмэлүүдийн нэг болох киннаматын урьдал нөхцөл юм. Фенилаланиныг биоген аминүүдийн нэг болох фенилэтиламинтэй метаболизмд оруулдаг. Фенилкетонурийн удамшлын өвчнөөр фенилаланиныг тирозин болгон хувиргахад фенилаланин ба түүний метаболитууд (фенилпируват, фенил лактат, фенилацетат, орто-гидроксифенил ацетат, фенилацетилглютамин) хуримтлагдаж, хэт сөрөг нөлөө үзүүлдэг.
D-, L- ба DL-фенилаланин
[засварлах | кодоор засварлах]D- фенилаланин (DPA)-ийг ердийн органик синтезийн аргаар нэг энантиомер эсвэл ракемийн хольцын нэг бүрэлдэхүүн хэсэг болгон гаргаж авах боломжтой. Энэ нь уураг бага хэмжээгээр агуулагддаг боловч ялангуяа боловсруулсан боловсруулсан хөгшин уураг, хүнсний уураг байдаг боловч уургийн биосинтезд оролцдоггүй. D-амин хүчлүүдийн биологийн үйл ажиллагаа тодорхойгүй хэвээр байгаа боловч D-фенилаланин нь ниацин рецептор 2-т фармакологийн идэвхитэй байдаг.
DL-фенилаланин (DLPA) -ийг өвдөлт намдаах эм, антидепрессант үйл ажиллагааны нэмэлт тэжээл болгон борлуулдаг. DL-фенилаланин нь D-фенилаланин ба L-фенилаланины холимог юм.DL-фенилаланины пестатив өвдөлт намдаах үйл ажиллагааг D-фенилаланины бөглөрөлтийг энкефалины доройтсон карбоксепептидаз А ферментээр тайлбарлаж болно.D-Фенилаланиныг биеийн цусны янз бүрийн эд эсүүдэд тархдаг.
L-Фенилаланин нь α2δ Ca2+ кальцийн сувагт 980 нм хэмжээтэй Ki антагонист юм. Тархинд L-фенилаланин нь NMDA рецепторын глициныг холбох газар ба AMPA рецепторын глютаматын холбох цэг дээр өрсөлдөх чадвартай антагонист юм.Л-Фенилаланин нь тархины концентрацийг 980 мкм-ийн багтаамжтай хиппокампус ба кортекс дэх глутаматтергическийн синапс дахь нейротрансмиттерийн ялгаруулалтыг дарангуйлдаг бөгөөд энэ нь сонгодог фенилкетонурийн үед тархины концентрацийг харуулдаг бол D-фенилаланин бага нөлөө үзүүлдэг.
- ↑ Dawson RM, et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
